Transfert en cours..., vous êtes sur le "nouveau" serveur data.abuledu.org dont l'hébergement est financé par l'association abuledu-fr.org grâce à vos dons et adhésions !
Vous pouvez continuer à soutenir l'association des utilisateurs d'AbulÉdu (abuledu-fr.org) ou l'association ABUL.
Suivez la progression de nos travaux et participez à la communauté via la liste de diffusion.
Votre recherche ...
Nuage de mots clés
Photographie, Piles électriques, Vêtements, Environnement, Couches-culottes, Verre, Journaux, Emballages alimentaires, Emballages, Emballages en matières plastiques, Déchets ménagers, Déchets organiques, Emballages en papier, Polystyrène, Tissus et textiles, Verre à vitres
Déchets ménagers
Déchets ménagers courants : 1) Le verre coloré ; 2) Les emballages en plastique souple (polyuréthanes) ; 3) Les emballages en plastique dur (PVC) ; 4) Les cartons gris et marron ; 5) Les récipients et objets en aluminium ; 6) Les boîtes de conserve en fer blanc ; 7) Les emballages en plastique imprimé, les emballages en papier alimentaire ; 8) Les emballages en polystyrène ; 9) Le verre blanc (vitre, vaisselle) ; 10) Les piles ; 11) Les autres métaux (sauf fer et aluminium) ; 12) Les déchets organiques (restes alimentaires, cheveux, plumes, filtres à café) constituent la fraction fermentescible des ordures ménagères (FFOM) ; 13) Les journaux, magazines, catalogues, annuaires, prospectus ; 14) Les tissus, vêtements, fils, fibres ; 15) Les autres déchets (couches-culottes, lingettes, déchets mixtes inclassables).
Photographie, Piles électriques, Mesure -- Instruments, allumettes, Règles, Électricité, Échelles (cartographie), Électricité -- Applications domestiques
Différents types de piles électriques
Différents types de piles électriques avec règle et allumette pour l'échelle.
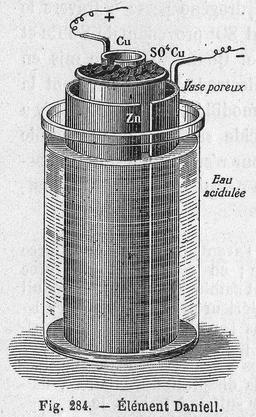
Élément Daniell
Illustration d'un élément de pile électrique Daniell. Source : Leçons de Physique ; Éditions Vuibert et Nony, 1904. La pile Daniell a été inventée par le chimiste britannique John Daniell en 1836 au moment où le développement du télégraphe faisait apparaître un besoin urgent de sources de courant sûres et constantes. La pile électrique Daniell est constituée d'une anode (lame de zinc plongée dans une solution contenant du sulfate de zinc) et d'une cathode (lame de cuivre plongée dans une solution contenant du sulfate de cuivre). Les deux solutions sont reliées par un pont salin (solution de chlorure de potassium (KCl)) qui sert à équilibrer les charges.
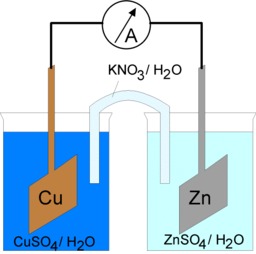
Le pont salin de Daniell
Schéma de principe d'un élément Daniell : Dans le pont électrolytique (ou pont salin), deux ions chlorure (Cl^-) dérivent vers la solution de sulfate de zinc ; alors que deux ions potassium (K^+) traversent le pont salin pour rééquilibrer la solution de cuivre. Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.
Montage de pont salin (Daniell)
Manipulation autour d'un montage avec un pont salin : pile Daniell qui débite. Dans le pont électrolytique (ou pont salin), deux ions chlorure (Cl^-) dérivent vers la solution de sulfate de zinc ; alors que deux ions potassium (K^+) traversent le pont salin pour rééquilibrer la solution de cuivre. Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.
Photographie, Piles électriques, Cuivre, Piles voltaïques, Zinc, Alessandro Volta (1745-1827), Physiciens italiens
Pile de Volta
Pile de Volta : La pile à colonne de Volta, ou pile voltaïque, ou encore pile Volta, fut la première pile électrique. Elle a été inventée par Alessandro Volta, qui publia un article à ce sujet en 1800. La pile voltaïque comporte un empilement de ronds de drap, puis de cuivre (ou d'argent), puis de zinc, groupe répété plusieurs fois et imprégné d'eau acidulée.
Peinture, Piles électriques, Piles voltaïques, Alessandro Volta (1745-1827), Électricité, Méthane, Physiciens italiens, Savants italiens
Portrait d'Alessandro Volta
Portrait d'Alessandro Giuseppe Antonio Anastasio Volta (1745-1827). Alessandro Volta fait ses études à Rome, et devient professeur de physique à l'école royale de Côme en 1774 ; il y met au point l'électrophore, première machine électrique à influence. Il étudie par ailleurs la composition du gaz des marais et isole, en 1778, le méthane. De 1780 à 1783, il visite la France, l'Allemagne, les Pays-Bas et l'Angleterre et collabore avec Antoine Lavoisier et Pierre-Simon de Laplace à une étude de l'électricité atmosphérique. Au début de l'année 1800, Volta publie dans une lettre en français datée du 20 mars au président de la Royal Society l'invention de la pile voltaïque qu'il a mise au point le 17 mars 1800. Le 7 novembre 1801, Volta présente sa pile devant l'Institut de France et y énonce la loi des tensions, ainsi que la valeur des tensions de contact des métaux classés par ordre d'électropositivité décroissante, du zinc à l'argent. Napoléon Bonaparte, qui assiste à cette séance, lui fait décerner une médaille d'or, lui accorde une pension et, le nomme comte et sénateur du Royaume d'Italie (1805-1814). L'étude de l'électricité fut toujours sa passion et, encore jeune étudiant, il écrivit un poème directement en latin, De vi attractiva ignis electrici ac phaenomenis inde pendentibus, sur ce phénomène fascinant et nouveau. C'est son premier écrit scientifique.
Photographie, Gravure, Piles électriques, Physiciens, Piles voltaïques, Alessandro Volta (1745-1827), Électricité, Physiciens italiens, Inventeurs
Portrait d'Alessandro Volta en 1816
Portrait du comte Alessandro Volta (1745-1827), en 1816. Volta est un physicien italien connu pour ses travaux sur l'électricité et pour l'invention de la première pile électrique, appelée pile voltaïque.
Photographie, Dessins et plans, loup, Lièvres, Bateaux, Grenouilles, Antiquités, Gravure, Peinture, Clip art, Balles et ballons, Amphibiens, Fleurs, Géométrie, Couleurs, Accumulateurs, Piles électriques, Plages, Forêts, Sable, Parasols, Cuisine (pain), Jardinage, Jardins, Réfrigérateurs, Réfrigération et appareils frigorifiques, Bains, Bovins de boucherie, Crustacés, Cuisine -- Appareils et matériel, Nuages, Produits viticoles, feu, Linux (système d'exploitation des ordinateurs), Compas, Salades, Livres illustrés pour enfants, Ombres, laine, Poisson, Plantes des jardins, Confitures, Outillage, Pêches, Cartes à jouer, Mer, Architecture végétale des jardins, Légumes, Potages, Navires à voiles, Découpage (cuisine), Viande, Viande -- Coupe, Étoiles, Cuisine (porc), Saucisses, Enseignes, Tables (meubles), Ongle, Cuisine (aliments naturels), Thé, Bleu, Mouton (viande), soleil, Cuisine (oeufs), Peur chez les animaux, Caricatures et dessins humoristiques, noir, Mécanique, Navires, Triangle, Oeufs, Baies (fruits), Porc, Émotions, Albums à colorier, Nombres cardinaux, Éléments de cuisine, Ustensiles de cuisine, Dinde (viande), Nouvelle-Zélande -- Civilisation, Boissons non alcoolisées, Peur, Pâtisseries, Familles, Fêtes -- Accessoires, Cuisine (fromage), Gelées (confiserie), Maillots de bain, Alimentation, Ciel, Temps -- Systèmes et normes, Oeufs -- Coquilles, Poissons d'eau douce, Parents et enfants, Cuisine (poisson), Véhicules prioritaires, Poulet (viande), Râteaux, Animaux des forêts, Cheminées, Couple -- Psychologie, Espace-temps, Cuisine (sucre), Bains de soleil, Terre, Veaux, Vents, Pyramides, Couple, Graines, Filage à la main, Poissons de mer, Rouge, Aluminium, Vert, Sacs, Membres, Cercle, Navires -- Équipement, Physique, Lumière, Lumière -- Propagation, Joie, Géologie -- Cartes, Poisson rouge, Saumon rouge, Agriculture -- Outillage, Coeur, Art médiéval, Trèfles, Pyramides -- Égypte, Cristaux, Blé, Batteries, Marbre, Fillettes, Caricature, Calcaire, Plantes méditerranéennes, Géométrie euclidienne, Navigation à voile, Cuisine (légumes verts), Sacs en tissu, Pelles, Thalès, Théorème de, Seizième siècle, Dix-neuvième siècle, Dix-septième siècle, Cuivre, Grumes, Albums, Pères, Pères et filles, Sentiers, Maisons individuelles, Pattes, Refus d'obéissance, Jardins médiévaux, Lièvre d'Europe, Méditerranée (région), Cuisine (thym), Aliments crus, Parapente, Vol libre, Dix-huitième siècle, France (Révolution) (1789-1799), Albrecht Dürer (1471-1528), Vinaigre, Poisson fumé, Poisson salé, Auckland (Nouvelle-Zélande), Nouvelle-Zélande (1945-....), Aliments, Cuisine (fruits), Aliments d'origine animale, Aliments fermentés, Cuisine (légumes), Produits de l'oeuf, Boissons alcoolisées, Hérodote (0484?-0420? av. J.-C.), Circulation, Vents -- Vitesse, Métamorphisme (géologie), Savants français, Cuisine (aliments crus), Cuisine (fruits de mer), Cuisine (aliments surgelés), Volaille (viande), Cuisine (poulet), Cuisine (volaille), Produits du blé, Sirops, Sauce à salade, Cuisine (viande), Cuisine (plantes odoriférantes), Crèmes (desserts), Entremets, Poisson surgelé, Agneau (viande), Desserts, Hors-d'oeuvre, Cuisine (baies), Cuisine (vinaigre), Ondes, Cuisine (céréales), Jeux de plage, Conduits d'évacuation de fumées, Fumées, Pull-over, Bronzage, Astérides, Seaux, Serviettes, Chlorure de sodium, Cycle hercynien, Boeuf (viande), Rôtis, Rotissoires, Plats complets, Astacidés, Cuisine (écrevisses), Décapodes (crustacés), Écrevisses, Vinaigrette, Champignons cultivés, Cuisine (champignons), Cuisine (truffes), Truffe du Périgord, Tubéracées, Cassis, Cassissier, Cuisine (cassis), Aliments -- Composition, Blanquette, Cuisine (veau), Veau (viande), Veaux -- Alimentation, Omble de fontaine, Poissonneries, Saumons, Saumons -- Pêche commerciale, Cuisine (semoule), Semoule, Cônes de pin, Pignons (graines), Aliments enrichis, Cuisine (restes), Tourtes, Deux, Jeux de société, Trois, Soupes, Infusions, Lumière, Théorie ondulatoire de la, Cuisson sur réchaud de table, Fondues, Savants allemands, Jumeaux, Interférence (optique), Rhubarbe, Augustin Fresnel (1788 - 1827), Diffraction, Ondes -- Diffraction, Énergie, Photons, Temps, Mesure du, France (Chute des Girondins) ( 30 mai-2 juin 1793), Exécutions capitales et exécuteurs, France (1793), Espace de Minkowski, Relativité (physique), Cônes de lumière, Relativité générale (physique), Architecture égyptienne, Constructions en pierres sèches, Cuisine (rhubarbe), Rhubarbes, Cuisine (boeuf), Cuisines, Aliments -- Consommation, Césium, Horloges à césium, Horloges atomiques, Berne (Suisse), Échelles de temps atomique, Temps (droit international), Johannes Kepler (1571-1630), Des révolutions des orbes célestes - Nicolas Copernic (1473-1543), Héliocentrisme, Énergie éolienne en mer, Portance, Aérodynamique, Relativité restreinte (physique), Muons, Rayons cosmiques, Aquarelle, Le lièvre - Albrecht Dürer (1471-1528), Peintres allemands, Cuisine (plantes aromatiques), Résistance à la chaleur, Thymus (plantes), Abats, Cuisine (abats), Tripes, Aliments -- Réfrigération, Entreposage frigorifique, Frigidaire, Frigo, Danse maorie, Ethnologie -- Nouvelle-Zélande, Linux (logiciels), Rugby, Bayonne (Pyrénées-Atlantiques), Ferias, Aliment, Chevreau (viande), Tacuini sanitatis - al-Muẖtār ibn al-Ḥasan ibn ʿAbdūn ibn Saʿdūn Ibn Buṭlān (10..-1066?), Tangram, Corrosion, Corrosion électrochimique, Assemblages à rivets, Corrosion galvanique, Réactions chimiques -- Mécanismes, Électricité, Symétrie, Constructions géométriques, Génie mécanique, Ressorts et suspension, Ressorts, Volutes, Algues marines, Algues -- Aspect économique, Navires -- Australie, Navires -- Déchets -- Élimination, Navires océanographiques, Navires -- Règlements de sécurité, Sargasses, Mer des, Auteurs arabes, Yuwānīs Ibn Buṭlān (10..-1066?), Jardins -- Aspect symbolique, Famille -- Anthropologie, Famille -- Loisirs, Famille -- Santé et hygiène, Mouton (laine), Quenouilles, Regroupement familial, Veillées, Scènes de la vie quotidienne, Vie quotidienne, Révolution industrielle, Projection cinématographique, Signes et symboles, Carreau, Cartes à jouer, Jeux avec, Pique, Trèfle, Chaleur -- Convection, Dissipateurs thermiques (électronique), Électronique, Acides aminés, Protéines
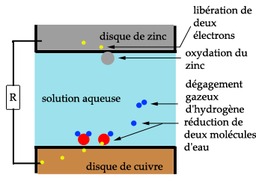
Schéma de la pile Volta
Schéma résumant le principe de fonctionnement de la pile Volta : disque de cuivre, disque de zinc, solution aqueuse. Oxydation du zinc : libération de deux électrons. Réduction de deux molécules d'eau, dégagement gazeux d'hydrogène. Il se produit au niveau de chaque couche, qu'on appellera désormais une superposition d'un disque de cuivre et d'un disque de zinc, séparés par un tissu retenant la solution, une réaction d'oxydo-réduction. Il ne se passe rien au niveau du disque de cuivre. Les éléments participant à l'oxydation et à la réduction sont les éléments zinc et eau. Au niveau atomique, l'oxydation d'un atome de zinc, selon la réaction Zn → Zn2+ + 2 e- produit deux électrons qui vont transiter dans le circuit électrique, pour atteindre le disque de cuivre. Les électrons vont alors rencontrer deux molécules d'eau, et une autre réaction de réduction va se produire, selon la réaction 2 H2O + 2 e- → 2 OH- + H2. On constate ainsi que le disque de zinc est petit à petit consommé et qu'il y a production de dihydrogène.
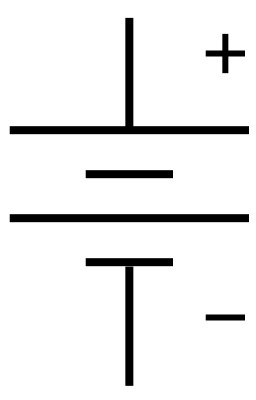
Symbole de circuit électrique
Symbole électronique d'une pile qui se réfère à la structure de la pile voltaïque. Chaque élément du couple oxydant/réducteur est relié à une électrode. Ces électrodes, lorsqu'elles sont reliées à un consommateur électrique, provoquent la circulation d'un courant électrique ; la réaction chimique provoque une circulation de charges (électrons, ions). Une pile fournit donc du courant continu. La borne (-) d'une pile correspond à l'anode où se produit la réaction d'oxydation qui va fournir les électrons. La borne (+) d'une pile correspond à la cathode où se produit la réaction de réduction qui va consommer les électrons. Source : http://fr.wikipedia.org/wiki/Pile_%C3%A9lectrique
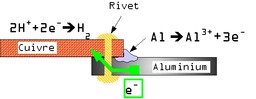
Corrosion galvanique
Corrosion galvanique, exemple d'un assemblage par rivet entre une tôle d'aluminium et de cuivre sans isolation. Une pile électrochimique est créée lorsque deux métaux de natures différentes sont mis en contact. Un des métaux s'oxyde et se dissout (anode), tandis que sur l'autre métal a lieu une réduction (cathode), et éventuellement formation d'une couche de produits de réaction (des espèces chimiques de la solution se réduisent et se déposent, notamment dépôt calco-magnésien). On parle de corrosion galvanique. Ce phénomène explique : le principe de la « protection cathodique par anode sacrificielle » : on crée une pile électrochimique qui impose un sens de parcours aux électrons pour empêcher la réaction de corrosion ; l'anode se dissout (elle est sacrifiée) et la cathode reste stable, elle est de plus parfois protégée par une couche de produits de réaction ; le principe de la « protection cathodique par courant imposé » : à la place de l'anode sacrificielle, on peut imposer le sens de parcours des électrons en établissant une différence de potentiel entre la pièce et le milieu avec un générateur de tension, par exemple alimenté par des panneaux solaires ; ce phénomène explique aussi pourquoi lorsque l'on met deux métaux différents en contact, l'un se corrode très rapidement. C'est exactement le même type de réactions chimiques qui ont lieu dans une pile d'alimentation électrique, une batterie ou un accumulateur.